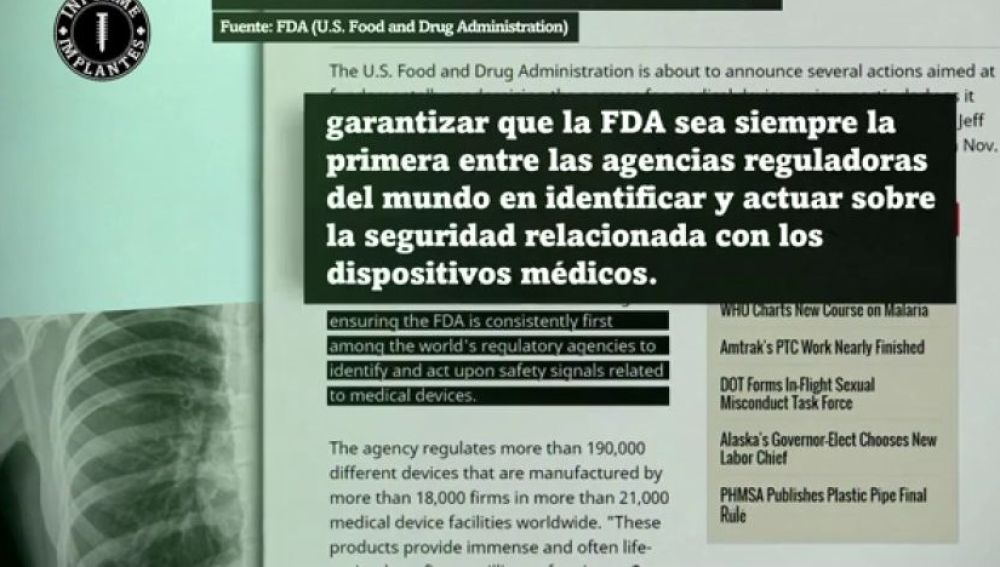
Asistimos estos días a un revuelo generalizado con la investigación «Informe Implantes» del Consorcio Internacional de Periodistas de Investigación hecho público hace unos días (enlace externo de La Sexta). Asunto complicado y espinoso. Da para un largo debate y sería muy interesante escuchar todas las opiniones y ángulos de las partes implicadas. Pero la realidad es que según el Informe Implantes, los fallos de diversos tipos de implantes y dispositivos médicos han ido creciendo en los últimos años y se pone de manifiesto un asunto que ha quedado en una evidencia llamémosle «doble»: por un lado la mejorable normativa que regula este tipo de dispositivos, y por otro la aparente deficiencia de calidad en los mismos. Hasta el punto de que una periodista participante en este informe consiguió pasar los controles de hasta tres organismos certificadores europeos en los que presentaba la red de una bolsa de mandarinas como un dispositivo médico (enlace externo). Y esto a pesar de haber aportado informes desfavorables que advertían de importantes fallos en el dispositivo. Sorprendentemente logró avanzar en el proceso de certificación. La conclusión está clara: el proceso regulatorio hace aguas. A raíz de este informe, la FDA (normalmente más rápida que nuestra homóloga europea) ya se ha apresurado a afirmar que va a modernizar y mejorar los procedimientos y normativas que regulan estos dispositivos. En Europa, la Agencia Europea del Medicamento aún no se ha pronunciado, pero es más que probable que siga los pasos de los norteamericanos en lo que parece una evidencia. Según afirma el Informe Implantes, mundialmente ascienden a 1500 fallos diarios. En España, cada día fallan 13 dispositivos de este tipo, cinco veces más que en el año 2008.

¿Cuál es el problema?
Está claro que los dispositivos pueden fallar, como falla cualquier otro dispositivo, ya sea un televisor, un coche o un móvil. El problema es que aquí hablamos de aparatos médicos de los que depende la salud o incluso a veces la vida. Por tanto, ¿cuál es el problema? ¿La cantidad de casos? ¿La escasa regulación normativa de la Administración para regularlos? ¿La calidad de estos dispositivos? Probablemente todo a la vez.
Todos queremos que un dispositivo médico sea altamente seguro. Como paciente lo desconozco, pero pongo la mano en el fuego a que la regulación sobre estos equipos es muy mejorable. Y sin embargo debería ser del máximo nivel de exigencia. Pero algo falla cuando muchos de los profesionales de salud preguntados también afirman que los controles son muy mejorables. Espero que todo este asunto sirva al menos para que a pesar de que las empresas digan que su calidad es superior, aún se mejore más. Para que también haya una exhaustiva normativa que regule más y mejor estos dispositivos. Para que en definitiva, los casos que este Informe Implantes saca a la luz se puedan reducir drásticamente. Según se afirma en el informe, lanzar productos al mercado sin prácticamente haberlos testado antes en ensayos clínicos serios se plantea en toda lógica una temeridad para cualquiera, por muy profano que seamos en estos asuntos. Y aunque nunca evitaremos este tipo de desgraciados incidentes porque hablamos de máquinas, sí que podemos hacer que se reduzcan y tener más confianza y seguridad en que uno de estos dispositivos nos va a ayudar y no a causarnos problemas.
La diabetes en el ojo del huracán
Las bombas de insulina aparecen en este informe entre los dispositivos con más incidencias. Y eso es algo que crea un lógico desasosiego entre nosotros. Como paciente, yo quiero que esto sirva para mejorar los niveles de exigencia, pero también entiendo que ahora se está produciendo un revuelo y una preocupación que podría ser desmesurada. Hay que poner calma. Ni todos fallan ni los fallos son letales. Es importante que estemos alerta con nuestros dispositivos, y que reclamemos cuando haya sospecha de fallos o problemas. Pero el problema es… ¿a quién reclamamos? Normalmente lo hacemos al fabricante, ya que nuestro equipo médico no nos puede solucionar nada. Y por tanto esa reclamación queda registrada directamente en la empresa fabricante, y la Administración puede que no tenga constancia de ella. Eso debería canalizarse de otro modo. En resumen, estoy convencido de que el Informe Implantes puede hacer que mejoren las cosas. Y espero que sea más pronto que tarde. Aquí en España llevamos por ejemplo tiempo asistiendo en las redes a un goteo de problemas con la bomba de insulina MiniMed 640G, que sin tener estadísticas en la mano, se ha convertido ahora mismo en el dispositivo de diabetes que más ruido en las RRSS genera en lo relativo a problemas, insatisfacciones e incidencias. Si bien es cierto que la lista de dispositivos es larga y afecta a muchas empresas, la multinacional americana está siendo ahora objeto de reportajes y noticias en los medios de todo el mundo. Probablemente por ser quien más cuota de mercado tiene en diversas áreas, lógicamente más casos acumula.
Objetivo: mejorar
Todo es mejorable en esta vida. Eso lo tenemos claro. Y el Sistema Sanitario, sus normativas y regulaciones también. Pero a raíz de leer algunos de los casos que se exponen en este informe (alguno de ellos alucinantes) quizá en este asunto las autoridades sanitarias se han dormido un poco en los laureles. Hablamos de aparatos que a veces marcan la diferencia entre vivir o morir. Los estándares de exigencia aquí deben ser máximos, y todos los esfuerzos que se realicen en mejorarlos nunca serán suficientes. Pero siempre hay que estar en el máximo nivel que se pueda. Por desgracia, la dinámica del mercado de consumo (porque al final somos clientes) y el capitalismo, han hecho que también la salud se vea afectada: los plazos de creación y lanzamiento de un medicamento se han acortado enormemente con respecto a hace años… los ensayos clínicos en ciertos productos no se producen o son exiguos… los costes de todo el proceso se han aquilatado (por usar un eufemismo)… Y todo esto no sale gratis. La consecuencia es un aumento en las posibilidades de que aparezcan problemas. Y aparecen. Está claro que lanzar un producto al mercado implica muchísima inversión, y ganar seis meses o un año para lanzarlo antes puede suponer mucho dinero. Pero insisto, hablamos de salud. Y ahí el fabricante debe ponerlo todo de su parte, aunque entiendo que es nuestra Administración quien al final debe tener el papel de garante de nuestra seguridad. Y hacer lo que haga falta para asegurar que estos dispositivos sean eficaces en su función, y también para que se beneficien de ellos el mayor número de personas posible, pero no a costa de su calidad. Seamos prácticos. Hagamos que este asunto del Informe Implantes sirva para que desde ahora, mejoremos sensiblemente en este tema (fabricantes y Administración) y todos estemos más seguros y hagamos las cosas mejor.

